Только ли укрепление господства США в XXI столетии является задачей тех идеологов трансформации, которые вознамерились превратить COVID-19 в то, что они именуют трансформационным или трансформирующим событием? Или же эти идеологи замахиваются на нечто большее?
Для того чтобы ответить на этот вопрос, мне придется обсудить одну, на первый взгляд чересчур специальную, сугубо научную проблему, без обсуждения которой мы не сможем получить ответ на волнующий нас вопрос о судьбе человечества в XXI столетии.
Между тем ковидная проблематика, как мы убедились, имеет именно такой судьбоносный характер. Это лежит на весах. Ну, а раз так, то придется заняться судьбоносными проблемами, лишь на первый взгляд являющимися узкопрофессиональными. Начнем сейчас с узкопрофессионального и тут же перейдем к чему-то резко более существенному и имеющему гораздо более общий характер. Но вначале вот это, узкопрофессиональное.
В 1987 году группа японских ученых, возглавляемая выдающимся молекулярным биологом Ёсиздуми Исино, столкнулась при изучении бактерии кишечной палочки (по латыни она именуется Escherichia coli — сокращенно E. coli) с тем, что в геноме этой бактерии есть повторяющиеся элементы, разделенные неповторяющимися последовательностями.
В 1989 году ученые, соратники Исино, опубликовали статью, в которой осмыслили существенность обнаруженного явления и его несводимость к тому частному случаю, который ими исследовался.
Микробиологи обсуждают, были ли тут японцы первооткрывателями или нечто аналогичное чуть раньше было обнаружено учеными из Калифорнийского университета в Беркли, работавшими вместе со своими шотландскими коллегами. Но все микробиологи согласны в том, что наиболее весомый вклад в изучение обсуждаемого нами феномена повторяемости внес испанский микробиолог Франсиско Хуан Мартинес Мохика.
Франсиско Мохика занимался не изучением генома бактерий кишечной палочки, как его японские предшественники, а изучением не имеющих ядра одноклеточных организмов, именуемых археями. Он изучал геном средиземноморских архей под названием Haloferax mediterranei. Галофераксы относятся к группе галофильных архей, которые формируют очень мощные популяции микробов в гиперсоленых средах, таких как части Средиземного моря или Мертвое море.
Изучая своих средиземноморских галофераксов, Франсиско Мохика установил, что они, как и изучаемые японскими коллегами кишечные палочки, содержат в геноме (который у них очень сильно отличается от генома кишечной палочки) сходные загадочные повторы. Мохика изумился этому. Мол, как же так, повторы-то совершенно сходные, а организмы очень разные.
Изумившись, Мохика предположил, что такие одинаковые повторы у очень разных микроорганизмов должны выполнять какую-то важную функцию. Он назвал эти повторы «короткие регулярно расположенные повторы» — short regularly spaced repeats (SRSRs).
В 2002 году голландскими исследователями — Янсеном и другими — был предложен термин «сгруппированные регулярные чередующиеся короткие палиндромные повторы» (запомнили?) — clustered regularly interspaced short palindromic repeats (CRISPR). Этот термин и стал общепринятым.
Термин «палиндром» происходит от греческого «возвращаться». В медицине он был впервые использован Гиппократом для обозначения заболевания, которое имеет тенденцию к повторению.
В микробиологии «палиндромными» называют зеркальные взаимно-комплементарные последовательности, способные складываться в некие шпильки, то есть вторичные структуры, которые легко себе представить, изогнув тонкую нитку или проволоку так, чтобы в основании оказалось два сближенных куска этой нитки, слагающих некий как бы стебелек, а на конце сформировалась петля.
При этом два куска нитки, находящиеся в основании стебля этой шпильки, в отличие от петли, обладают комплементарностью, то есть способны соединяться друг с другом, перегибаться одна к другой. Такие шпильки впоследствии особо подробно изучались в связи с интересующими нас рибонуклеиновыми кислотами (РНК), да и не только с ними.
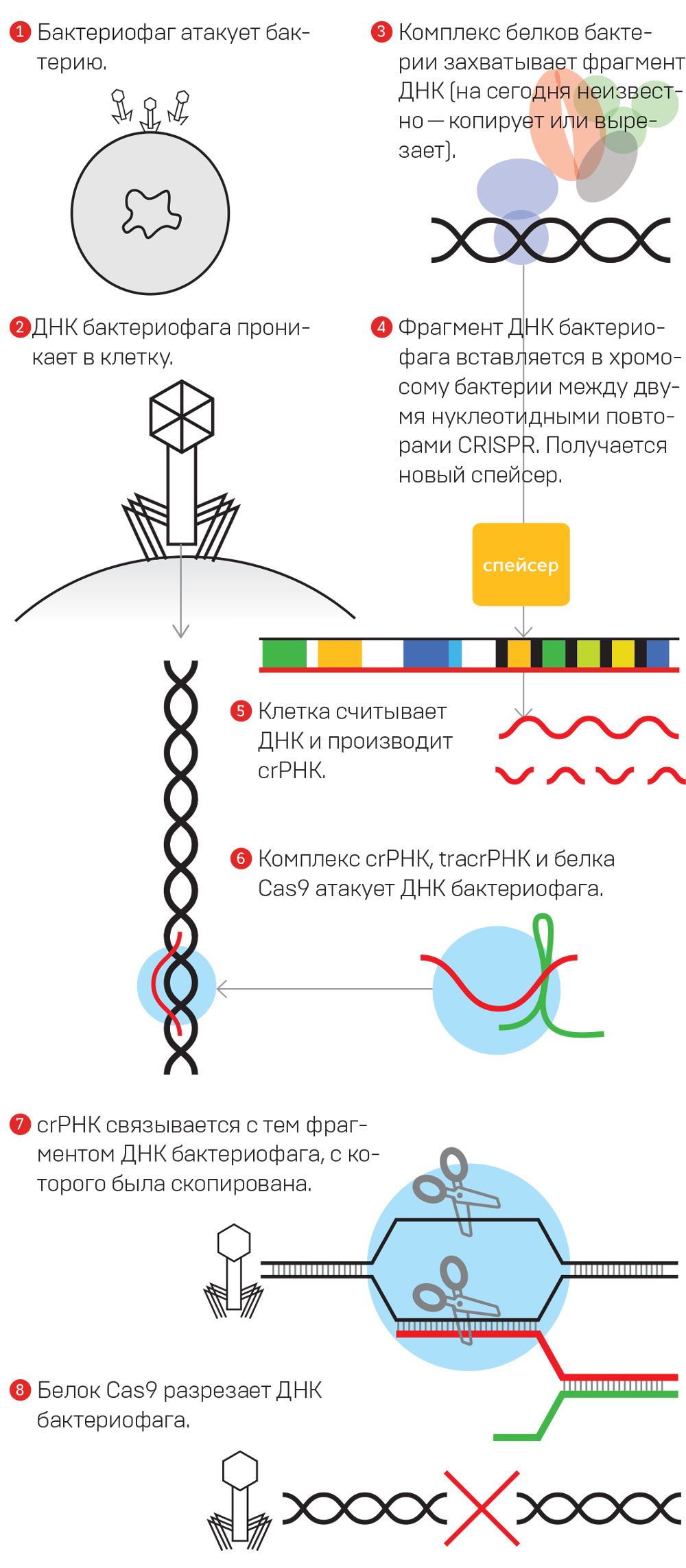
Итак, Мохика обнаружил в 1993 году наличие так называемых CRISPR-кассет, то есть блоков, состоящих из повторяющихся шпилек. Такие повторяющиеся CRISPR-кассеты чередуются так называемыми спейсерами, то есть уникальными, неповторяющимися вставками, каждая из которых имеет примерно такую же длину, как CRISPR-кассета.
К подобным кассетам примыкают кластеры совокупности генов, именуемые Cas.
Обнаружив все это, Мохика не удовлетворился частными сопоставлениями, а начал анализировать то, насколько общим является обнаруженное им CRISPR-Cas.
Начиная с 1995 года, Мохика раз за разом обнаруживал аналогичные загадочные повторы у самых разных микроорганизмов. Однако поначалу ему была непонятна функция этих повторов — что, собственно, они должны делать?
Работы Мохики вдохновили очень многих ученых на изучение того явления, которое, как выяснилось, носит далеко не частный характер.
В 2002 году голландские ученые сначала назвали обнаруженное общее явление повторов — CRISPR (помните, Янсен?), а потом указали на то, что к этим повторам примыкают ассоциированные Cas-гены, вот эти совокупности генов.
К 2005 году было доказано, что CRISPR-Cas имеет прямое отношение к иммунитету у одноклеточных.
В 2007 году были получены экспериментальные доказательства того, что обнаруженное CRISPR-Cas имеет решающую роль в иммунной системе бактерий.
В 2011 году было получено первое доказательство того, что система CRISPR-Cas может быть перенесена из одного организма в другой. И что при таком перенесении у организма, в который перенесена эта самая CRISPR-Cas, возникает иммунитет против определенных инфекций.
В 2012 году было уже напрямую сказано, что CRISPR-Cas — это новое слово в том, что касается (внимание!) редактирования любых геномов, включая геном человека.
Ну вот и стало ясно, зачем я так долго занимался обсуждением того, какие исследования проводились по отношению к каким-то там микроорганизмам — кишечным палочкам, каким-то бактериям, размножающимся в соленых водах, археям и так далее. Я занимался этим, только для того, чтобы выйти на тему редактирования генома, она же — тема генной модификации или трансформации. Генной модификации — чего? Трансформации — чего? Генома — чьего? Растения, животного, человека?
Имеет ли эта тема отношение к ковиду? Хотят ли этот самый ковид использовать только для трансформации образа жизни и функционирования экономики? Взяли, всех заперли, какие-то части экономики остановили, создали другой образ жизни, другую экономику. Или же для кого-то этот ковид является толчком аж к генной трансформации человека, она же более мягко именуется «редактирование генома»? Никакой разницы между генной модификацией человека и редактированием человеческого генома нет.
Для ответа на вопрос о том, хотят ли трансформаторы трансформировать только общество, экономику и все прочее, а уже через это человека, или же они хотят вдобавок зайти с другого конца и через человека, трансформируя человека, прийти к глубоким трансформациям всего и вся, или же они копают с двух концов… Вот для того чтобы на это ответить, нужен короткий экскурс в историю научного направления, которое называется редактирование генома.
Этим самым редактированием геномов занимались самые разные исследователи. Они предложили различные методы редактирования. И тут важно, какое именно место занимает CRISPR-Cas внутри всей этой совокупности методов редактирования генома.
В 2007 году Нобелевскую премию по физиологии и медицине получили американский генетик Марио Капекки, англо-американский генетик Оливер Смитис и английский генетик сэр Мартин Джон Эванс. Они получили эту премию за изобретение так называемого метода нокаутирования генов, одного из тех методов редактирования генома, которые совершенно необходимо обсуждать все в совокупности в связи с ковидом.
Что такое нокаутирование генов?
Нокаут — это метод молекулярной генетики, при котором из организмов удаляются или делают неработоспособными определенные гены.
Организмы, у которых удален определенный ген, называются нокаутированными. Широко исследуются, например, нокаутированные мыши. И поэтому нет оснований считать, что не может быть нокаутированных обезьян или людей. То есть существ, в которых удалены определенные гены.
Итак, Марио Капекки, Оливер Смитис и Мартин Эванс получили в 2007 году Нобелевскую премию за осуществление этого самого нокаутирования. И с этого началось развитие направления под названием «геномное редактирование» или «редактирование генома».
Для того чтобы осуществить нокаут, нужно сначала прицелиться, а потом нанести удар. В генетике такое прицеливание называется таргетинг генов или таргетирование — от английского слова target — мишень.
Для осуществления таргетинга стволовые клетки эмбриона подвергаются определенным воздействиям, а затем клетки с видоизмененным геном пересаживаются в бластоцисту, то есть в раннюю стадию развивающегося зародыша (это все очень важно, вы скоро увидите, что этим уже буквально занимаются). После чего и возникает химера с измененным целевым геном.
Хочу подчеркнуть, что тут никакой разницы между бластоцистой мыши или бластоцистой любого млекопитающего, включая человека, нет.
Не имея возможности перегружать эту статью подробностями, сообщаю, что обычные методы геномного редактирования связаны с очень сложными разрывами в ДНК — вот как это нокаутирование (надо что-то выбить и так далее). А технология CRISPR-Cas в ее различных модификациях (сейчас обсуждается технология применения CRISPR-Cas9) позволяет отредактировать геном гораздо более просто. Его можно нокаутировать — это сложнее, а можно CRISPR-Cas9 осуществить по отношению к нему — и будет проще. А редактирование все равно будет.
Такое редактирование на основе CRISPR-Cas9 впервые было осуществлено в 2012 году. Возможность такого редактирования генома человека обсуждалась и у нас в России. Но я не хотел бы сразу фокусироваться в этих передачах на наших отечественных, зачастую легковесных, а зачастую очень даже далеко идущих потугах.
А вот в Китае в 2018 году редактирование генома на основе CRISPR-Cas9 было осуществлено очень лихо. Осуществил это редактирование китайский ученый из Южного университета науки и технологий в Шэньчжэне Хэ Цзянькуй. Не он был первооткрывателем возможности редактирования человеческого геномного материала в пробирках. Но он впервые такой отредактированный геном не уничтожил, как полагалось, а подсадил в бластоцисту реальной женщины.
Задачей ученого было отключение того самого гена CCR5, который связан с формированием белка, позволяющего вирусу ВИЧ попасть в человеческую клетку.
25 ноября 2018 года Хэ Цзянькуй сделал следующее заявление:
«Две прекрасные маленькие китайские девочки, которых назвали Лулу и Нана, пришли с плачем в наш мир пару недель назад здоровыми, как и другие дети. Грейс забеременела в результате обычной процедуры искусственного оплодотворения, лишь с одним отличием: сразу после того, как ее яйцеклетки были оплодотворены спермой ее супруга, мы ввели в клетки чуть-чуть белка и инструкции для редактирования генома. Когда Лулу и Нана представляли собой одну-единственную клетку, эта операция устранила портал, через который ВИЧ проникает в клетку, инфицируя людей. Я понимаю, что моя работа вызовет острую дискуссию. Но я верю, что семьи нуждаются в этой технологии, и за них я готов подвергнуться критике».
Вы понимаете, о чем идет речь? Речь идет о том, чтобы осуществить такое редактирование человеческого генома, с помощью которого человек (о, счастье!) уже не сможет заразиться СПИДом. Ну просто не сможет, и всё.
Но если можно осуществить такое редактирование генома, при котором человек не сможет заразиться СПИДом, то почему не попытаться осуществить редактирование генома, с помощью которого человек не сможет заразиться «ужасным ковидом»? Почему в итоге не превратить все человечество в людей, не способных за счет редактирования генома заболеть этим, этим, этим и этим. А потом еще и этим. А дальше — больше… Что произойдет при этом с человеком — отдельный вопрос. Главное, что он не заболеет и не заразит других.
Еще раз обращаю внимание зрителя на то, что когда неоконсерваторы говорят о трансформирующем или трансформационном событии, то они имеют в виду катастрофу, способную отредактировать исторический процесс в нужном для них направлении. Можно даже сказать — отредактировать исторический, социокультурный геном человечества. Таким событием может быть ковид или что-то другое.
Но когда говорят о борьбе с ужасными злоключениями, невесть откуда появившимися, на уровне не человечества, а отдельного человека, то совершенно ясно, что раньше или позже будет сказано о необходимости отредактировать каждый отдельный геном. И трансформационным событием будет названа такая редакция. С помощью чего? С помощью соответствующих лекарств, осуществляющих редакцию генома и потому имеющих название трансформирующие или трансформационные. И сколько бы ни лавировали творцы подобных лекарств, утверждая, что они всего лишь являются прорывными, спасительными, а трансформационными они их называют просто так, по случайности, суть данного «спасения» начинает выявляться все больше.
«Спасение» каждого отдельного человека, способное соткать из таких отдельных микроспасений спасение всего человечества, может осуществляться с помощью трансформации — уже не человечества, а сначала человека, а потом и человечества. Речь идет о трансформации человеческой биологической сути, то есть генома. А осуществлять это должны трансформационные или трансформирующие лекарства, без которых, как без воды, «и ни туды, и ни сюды».
А чего ж вы хотите? Болеть? Гибнуть? Других заражать? Нет, спасение найдено! Мы вас будем трансформировать, ваш геном. А что делать, скажут, если единственная возможность спасти вас от жутких заболеваний, невесть откуда появившихся, — это отредактировать ваш геном? Вы тогда заболеть не сможете. Может быть, вы еще чего-то не сможете, но это вопрос частный. Главное, что вы заболеть не сможете, и будете спасены. То есть окажетесь трансформированы за счет использования трансформационных лекарств и трансформационной медицины, которая залезет в геном.
Мне бы хотелось после такого принципиально важного отступления доразобрать историю с Хэ Цзянькуем и его спасительными трансформациями неких буквально генномодифицированных близнецов, которые должны были стать невосприимчивы к СПИДу.
Эти генномодифицированные близнецы появились на свет божий и получили имена Лулу и Нана. Их так и называют — отредактированные близнецы.
9 января 2019 года, через месяц с небольшим после того, как Хэ Цзянькуй объявил о своих экспериментах, телеканал «Звезда» сообщил о том, что он может понести тяжкое наказание за эти эксперименты: «В Китае смертельную инъекцию могут сделать человеку, чьего преступления никто даже не видел. Речь идет об ученом, которому удалось добиться рождения первых в мире генетически модифицированных детей».
Ранее, 27 ноября 2018 года, на «Первом канале» вышел репортаж о Хэ Цзянькуе и его экспериментах. В репортаже говорилось:
«На свет впервые появились генномодифицированные дети. Нигде в мире подобные опыты с людьми не разрешены, но все понимают, что рано или поздно наука перешла бы эту черту.
Хэ Цзянкуй: Мир пришел к стадии генной модификации эмбрионов. Если не я этим буду заниматься, то кто-то иной продолжит исследования.
Ведущая: Доктор Хэ исследования держал в тайне от научного сообщества. Университет доктора Хэ поспешил откреститься от него: мол, мы ничего и не знали. А власти КНР отреагировали так.
Официальное заявление Государственного комитета КНР по делам здравоохранения и планового деторождения: «СМИ сообщили о рождении генномодифицированных младенцев с иммунитетом к ВИЧ. Комитет пристально следит за этим фактом. Уже дано поручение Комитету по вопросам здравоохранения провинции Гуандун провести тщательное расследование этого эксперимента».
Сама технология редактирования генома, мягко говоря, не новая. Ее давно используют в селекции агрокультур, а в том же Китае с помощью этой технологии меняют ДНК животных».
30 декабря 2019 года «Вести» подытоживают: «Никто, в конечном счете, не знает, к каким дальнейшим мутациям может привести изменение или удаление одного-единственного гена».
Для генной модификации Хэ Цзянькуй использовал такой инструмент редактирования человеческого генома, как система CRISPR-Cas9, являющаяся своеобразными молекулярными ножницами, с помощью которых можно разрезать ДНК.
Видите, как все просто. Разрезал. Удалил ненужное. Подсадил что-то. Бац — вы спасены… От кого — от себя? И спасены ли?
28 ноября 2018 года на саммите генетиков в Гонконге Хэ Цзянькуй сетовал на осложнения, которые могут возникать при редактировании генома такими способами. Он, мол, хотел воссоздать такую мутацию в одном из генов, которая защитит от ВИЧ. Однако выяснилось, что эта мутация может повлечь изменения в других генах, где производить мутацию не предполагалось. В частности, он продемонстрировал на слайде, что у клеток, взятых у одной из девочек — Лулу — на стадии, когда это был еще эмбрион, произошла такая дополнительная непредусмотренная, «нецелевая» мутация.
Хэ Цзянкуй заявил: «Этот промах произошел в межгенной области. Хотя мы не можем подтвердить, было ли это унаследовано или произошло в результате редактирования. Согласившиеся на процедуру были проинформированы о риске существования одного потенциального промаха. И они решили провести имплантацию».
Ну уж, знаете ли… Зато СПИДом не заболеют.
Многие представители научного сообщества выступили в адрес Хэ с резкой критикой. Ученые отмечают, что если посмотреть на данные, представленные Хэ, то видно, что он не создал мутацию гена CCR5, в точности повторяющую естественную, которая встречается в Северной Европе. Он создал некое подобие. К каким последствиям приведет этот «подобный» ген, не знает никто. Хэ не проверял на устойчивость к СПИДу ни Лулу, ни Нану, ни даже другие эмбрионы, отредактированные подобным образом. Так что есть ли эта устойчивость к СПИДу — неизвестно. А вот редактирование генома уже есть.
На саммите в Гонконге Хэ заявил, что только что передал свою статью, описывающую проделанную им работу, в научный журнал. Однако эта статья так и осталась неопубликованной. Тем не менее часть научного сообщества сумела с ней ознакомиться.
3 декабря 2019 года в журнале MIT Technology Review вышла статья Антонио Регаладо, который является в этом журнале старшим редактором по биомедицине. В статье Регаладо представлен анализ и критика неопубликованной статьи Хэ, которую Регаладо читал, а также приведены цитаты из этой статьи. В частности, в критической статье говорится, что, хотя члены команды Хэ ожидали, что (цитирую) «эти правки придадут устойчивость к ВИЧ, сводя на нет активность гена, они не могут знать наверняка, потому что правки „похожи“, но не идентичны дельте 32 CCR5, мутации, которая происходит в природе. Более того, только один из эмбрионов имел правки для обеих копий гена CCR5 (по одному от каждого родителя)». В случае другого эмбриона «был отредактирован только один [имеется в виду ген одного родителя], давая в лучшем случае частичную устойчивость к ВИЧ».
В статье приводится мнение исследователя Хэнка Грили, который заявляет по поводу эксперимента, осуществленного Хэ: «Успешность» здесь сомнительна. Ни у одного из эмбрионов не удалились все 32 пары оснований в CCR5 — мутация, известная по миллионам людей. Вместо этого эмбрионы/возможные дети получили новые вариации, последствия которых не ясны. Кроме того, что означает «частичная устойчивость» к ВИЧ? Насколько частичная? И было ли этого достаточно, чтобы оправдать перенос эмбриона с геном CCR5, никогда не встречавшимся у людей, в матку для возможного рождения?»
В данных, приложенных к неопубликованной статье Хэ, приведены таблицы, которые он ранее продемонстрировал на конференции. Как отмечает MIT Technology Review, на этих таблицах показаны хроматограммы или считывание последовательностей ДНК, обнаруженных в эмбрионах и тканях рождения близнецов (пуповина и плацента), когда эта группа пыталась выяснить, какие изменения реально произошли с геном CCR5.
Некоторые исследователи, — например Киран Мусунуру, ассоциированный профессор кардиоваскулярной медицины и генетики из Пенсильванского университета, автор сопроводительной статьи в MIT Technology Review, — убеждены: приведенные Хэ данные ясно показывают, что эмбрионы являются «мозаичными», то есть разные клетки эмбриона были отредактированы по-разному.
Регаладо пишет: «Смысл данных заключается в том, что тела близнецов могут состоять из клеток, отредактированных по-разному или не отредактированных вообще. Это, отмечает Мусунуру, означает, что только некоторые из их клеток могут иметь ген устойчивости к ВИЧ; это также означает, что некоторые могут иметь необнаруженные „нецелевые“ изменения, которые потенциально могут вызвать другие проблемы со здоровьем. Проблема мозаичности была хорошо известна Хэ из его экспериментов на эмбрионах животных. Одна из загадок исследовательского проекта заключается в том, почему Хэ решил продолжить работу с эмбрионами, если они были испорчены таким образом».
Что сейчас происходит с близнецами Лулу и Наной — неизвестно, власти Китая это скрывают.
Американские генетики модифицировали систему CRISPR-Cas9 и научили ее более эффективно редактировать геном.
Вкратце речь идет о том, что ножницами для редактируемой ДНК является белок Cas9, к которому добавляется короткая РНК-молекула-гид, задача которой — именно это самое таргетирование. То есть направление ножниц в то место генома, где они должны сделать разрез.
После того как молекула находит нужный участок, Cas9 разрезает обе нити ДНК, затем в геном вносится нужное изменение, потом происходит сращивание цепей ДНК, которое позволяет восстановить целостность ДНК-молекулы. В некоторых случаях процесс восстановления двуцепочечных разрывов вызывает появление мутаций: инсерций (вставок дополнительных оснований) или делеций (с удалением нескольких оснований).
Задолго до всяких там CRISPR-Cas и прочих таргетирований было обнаружено явление под названием апоптоз, то есть клеточное самоубийство.
В двух словах — было обнаружено, что клетка рассматривает двуцепочечные разрывы, которые делают эти умники, как очень опасное событие. И в ответ на него запускает этот самый апоптоз. Ведь двуцепочечные разрывы могут происходить не только по причине таргетирования генома всякими там CRISPR-Cas. Они могут возникнуть, например, в результате действия радиации.
Клетка может осуществить апоптоз. А может начать лихорадочно склеивать разорванные концы ДНК. Причем склеивать очень быстро и как попало. Тогда на месте разрыва возникает мутация в виде пропуска, именуемого делеция, или избытка, именуемого инсерция.
Всё это вместе может породить полную поломку генома.
Хэ Цзянькуй считал, что в клетках человека произойдет то, что происходит, например, в клетках дрожжей. То есть что после разреза и изменения начнется точный ремонт на основе существующего образца ДНК.
Но в клетках человека этот ремонт происходит совсем не так безупречно, как в клетках дрожжей. Его место зачастую заменяет срочный аварийный ремонт, который очень неточен. Именно поэтому Хэ Цзянькуй не сумел отредактировать геном близнецов так, как было задумано.
Но это не остановило последователей Хэ Цзянькуя. Группа исследователей из Гарварда под руководством Дэвида Лю предложила новый способ редактирования генома. Он называется праймированное редактирование.
Ученым удалось добиться нужной мутации элемента Cas9. После этой мутации ножницы Cas9 могут разрезать только одну цепочку ДНК.
Молекулу-гид гарвардские ученые удлинили. И добавили в нее последовательность, которая вызывает алгоритм починки разрыва.
Одновременно к белку Cas9 пришили праймер. Отсюда и термин «праймированное редактирование генома».
И хотя все это по-прежнему остается достаточно опасным в силу невозможности точного спаривания РНК с генетическим банком, расположенным в ДНК, ученые настаивают на том, что опасность теперь стала меньше, что риск нежелательных мутаций снижен. На уровне эксперимента ученые уже смогли справиться с рядом заболеваний на уровне редактирования генома… Ждите лекарств и операций.
В конце 2019 года Джон Коэн, американский корреспондент из журнала Science, захотел встретиться в Москве с человеком, который именует себя последователем Хэ Цзянькуя. Этого человека зовут Денис Ребриков. Он является заведующим лабораторией геномного редактирования Научного центра акушерства, гинекологии и перинатологии им. В. И. Кулакова.
Ребриков сообщил о том, что он хочет отредактировать геном, исправив наследственную глухоту. И что он решил согласовать эксперимент в Минздраве.
30 декабря 2019 года Ребриков заявил в программе «Вести»: «Существуют пары уже с заболеванием, например, глухота или карликовость, у которых все дети будут с таким же заболеванием. И тогда единственный способ, чтобы ребенок родился обычным — это исправить мутацию, починить».
Уже проходят клинические испытания отредактированных стволовых клеток крови. Испытания осуществляются для того, чтобы резко продвинуться в терапии рака и СПИДа.
Американская компания Netflix выпустила четырехсерийный документальный фильм «Неестественный отбор» (пародируется дарвиновское «естественный отбор»). В фильме обсуждается всё, что касается редактирования человеческого генома. В трейлере к фильму сказано: «Сколько инъекций вы себе сделали? Теперь мы сами распоряжаемся своими судьбами. Если ты действительно играешь дальше, то тебе все равно, что думают другие люди».
Что же касается редактирования генома растений или генома животных, то тут всё разворачивается полным ходом. И чемпионом в том, что касается этого направления, на котором базируется вся индустрия ГМО (ГМО — это генномодифицированный — или отредактированный — организм), является та самая компания Monsanto, которую мы обсуждали в связи с господином Гейтсом.
Но этот господин, которого очень крупные силы, буду повторять постоянно, назначили застрельщиком в чрезвычайно крупной игре, обзаводится самыми разными инструментами. Один из них — Monsanto, другой — Moderna, которую не надо путать с Monsanto, и которую мы детально обсудим чуть позже. А есть еще и те инструменты, которые связаны с этим самым CRISPR-Cas9. Нам всё это придется обсудить для того, чтобы разобраться в самой стратегической подоплеке ковидной эпопеи.
(Продолжение следует.)